Como os ácidos e bases de Lewis diferem dos ácidos e bases de Bronsted / Lowry?
Responda:
Os ácidos e bases de Lewis são definidos em termos de poder aceitar ou doar pares de elétrons. Embora os ácidos e as bases Bronsted Lowry sejam definidos em termos de poder aceitar ou doar íons hidrogênio (#H^(+)#).
Explicação:
• Um ácido de Brønsted-Lowry é qualquer substância (molécula ou íon) que pode doar um íon hidrogênio (#H^(+)#).
• Uma base Brønsted-Lowry é qualquer espécie que possa aceitar um íon hidrogênio (#H^(+)#).
#color(blue) ("Take the reaction below for example:")#
#HNO_2+ H_2O rightleftharpoons H_3O^(+) + NO_2^(-)#
Ácido nitroso (#HNO_2#) é o ácido Brønsted-Lowry porque doa um íon hidrogênio à água. A água é a base de Brønsted-Lowry porque aceita o íon hidrogênio.
#color(red)("On the other hand")#, Ácidos e bases de Lewis são definidos em termos de ser um doador de pares de elétrons ou um aceitador de pares de elétrons.
• Um ácido de Lewis é definido como um aceitador de pares de elétrons. Isso significa que os ácidos podem aceitar um par solitário de elétrons de uma base de Lewis porque o ácido possui orbitais de valência vazios.
• Um ácido de Lewis deve ter um orbital de valência vago e pode ser um cátion, como #Al^(3+)#ou uma molécula neutra, como #CO_2#.
• Uma base de Lewis é um doador de pares de elétrons. Isso significa que uma base de Lewis tem a capacidade de doar dois de seus elétrons para um ácido de Lewis.
Aqui está uma descrição geral de uma reação ácido-base de Lewis:
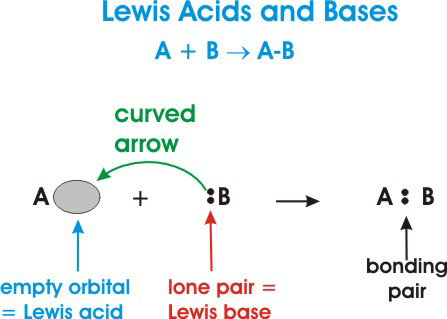
No diagrama acima, #A# é um ácido de Lewis porque está aceitando um par de elétrons de #B# como indicado pela seta curva.
#B# é uma base de Lewis está doando seus elétrons para #A#.

