Como preencho orbitais de ligação e anti-ligação?
Depois de desenhar e rotular os orbitais moleculares, você os preenche na mesma ordem que os orbitais atômicos.
As regras usadas para o preenchimento de orbitais atômicos são:
1. Princípio Aufbau
Você coloca elétrons nos orbitais de menor energia disponíveis.
2. Princípio de exclusão de Pauli
Nenhum orbital pode conter mais de dois elétrons, e eles devem ter rotação oposta.
3. Regra de Hund
Todo orbital em um subshell deve conter apenas um elétron antes que qualquer orbital possa ter dois elétrons. Todos os elétrons em orbitais ocupados individualmente devem ter o mesmo giro.
Você usa as mesmas regras para preencher orbitais moleculares.
Vamos aplicar isso ao diagrama orbital molecular do oxigênio.
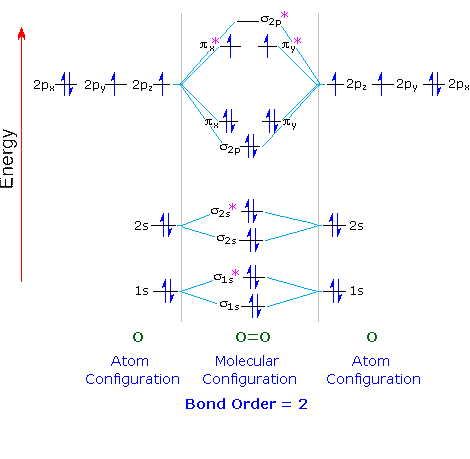
Cada átomo de O contém elétrons 8, então temos elétrons 16 para colocar nos orbitais moleculares de O₂.
Colocamos dois elétrons em cada um dos σ1s, σ1s, σ2s, σ2se σ2p (elétrons 10).
Os próximos quatro elétrons seguem a Regra de Hund e entram em ordem #π_x#, #π_y#, #π_x#e #π_y# orbitais.
Os dois elétrons restantes seguem a Regra de Hund e entram em ordem #π_x^"*"# e #π_y^"*"# orbitais.
Uma molécula de oxigênio tem dois elétrons não emparelhados.

