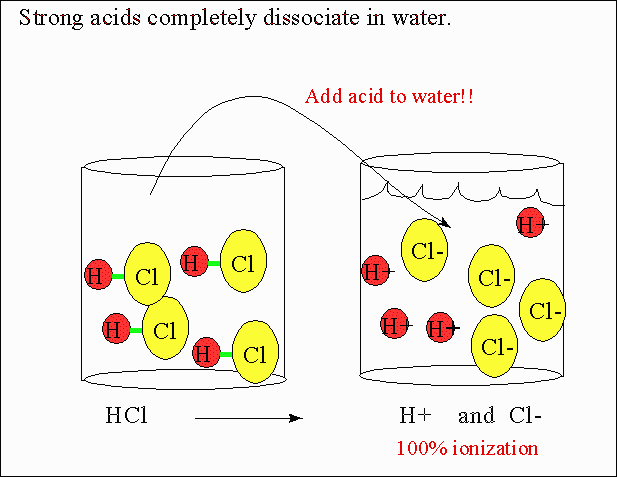
Os ácidos fortes se dissociam completamente na água?
Para todos os efeitos práticos, os ácidos fortes se dissociam completamente na água.
Essa é a definição: A ácido forte é um ácido que se dissocia completamente na água.
Em teoria, toda reação é uma reação de equilíbrio. Por exemplo
HCl + H₂O ⇌ H₃O⁺ + Cl⁻
#K_"a" ="[H₃O⁺][Cl⁻]"/"[HCl]"# = 1.55 × 10⁶
Vemos que a posição de equilíbrio está muito à direita.
Podemos calcular que, no 1 mol / L HCl, existem mais de íons 1200 H₃O⁺ para cada molécula de HCl não dissociado.
Para todos os fins práticos, o HCl é completamente dissociado em solução.
Os ácidos fortes têm uma grande constante de dissociação, portanto se dissociam completamente na água.