Por que o calor da hidrogenação do benzeno é menor que o esperado?
Responda:
O calor da hidrogenação é menor que o esperado porque o benzeno é estabilizado por ressonância.
Explicação:
Calor de hidrogenação
O ciclohexeno possui uma ligação dupla e seu calor de hidrogenação é -120 kJ / mol.
O benzeno tem três ligações duplas, portanto, podemos esperar que seu calor de hidrogenação seja -360 kJ / mol.

No entanto, seu calor medido de hidrogenação é de apenas -208 kJ / mol.
O benzeno é mais estável do que o esperado por 152 kJ / mol. Essa diferença é chamada de energia de ressonância.
Ressonância

Podemos escrever duas estruturas de Lewis para o benzeno, diferindo apenas nas posições dos elétrons.
Sempre que podemos fazer isso, a estrutura correta não é uma das duas. É um híbrido de ressonância dos dois.
Essa estrutura é mais estável do que qualquer um dos colaboradores, e a estabilização extra é chamada de energia de ressonância do composto.
A explicação orbital
Podemos entender isso em termos dos orbitais envolvidos.
Os átomos de carbono no benzeno são #"sp"^2# hibridizados e os não hibridizados #"p"_z# orbitais se sobrepõem lateralmente para formar as nuvens π do #"C=C"# ligações duplas.
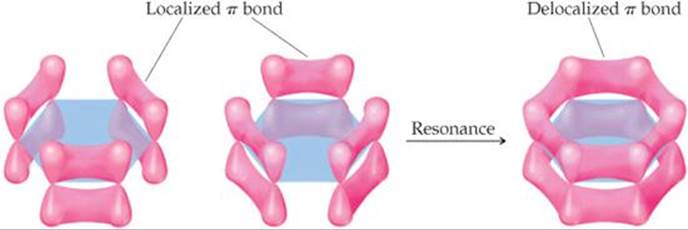
Todos os seis #"p"# os orbitais podem se sobrepor para formar uma nuvem π "deslocalizada" de elétrons ao redor do anel.
Sempre que os elétrons podem se espalhar ou "deslocalizar", eles estão em níveis mais baixos de energia.
A sobreposição pode parecer pequena no diagrama acima.

(Adaptado do Physics Stack Exchange)
No entanto, a imagem desenhada por computador acima mostra que #"2p"# os orbitais são realmente muito mais "gordos" do que as formas alongadas de gota de lágrima que costumamos desenhar, e os átomos de carbono estão próximos o suficiente um do outro, de modo que a sobreposição lateral dos orbitais é bastante significativa.

