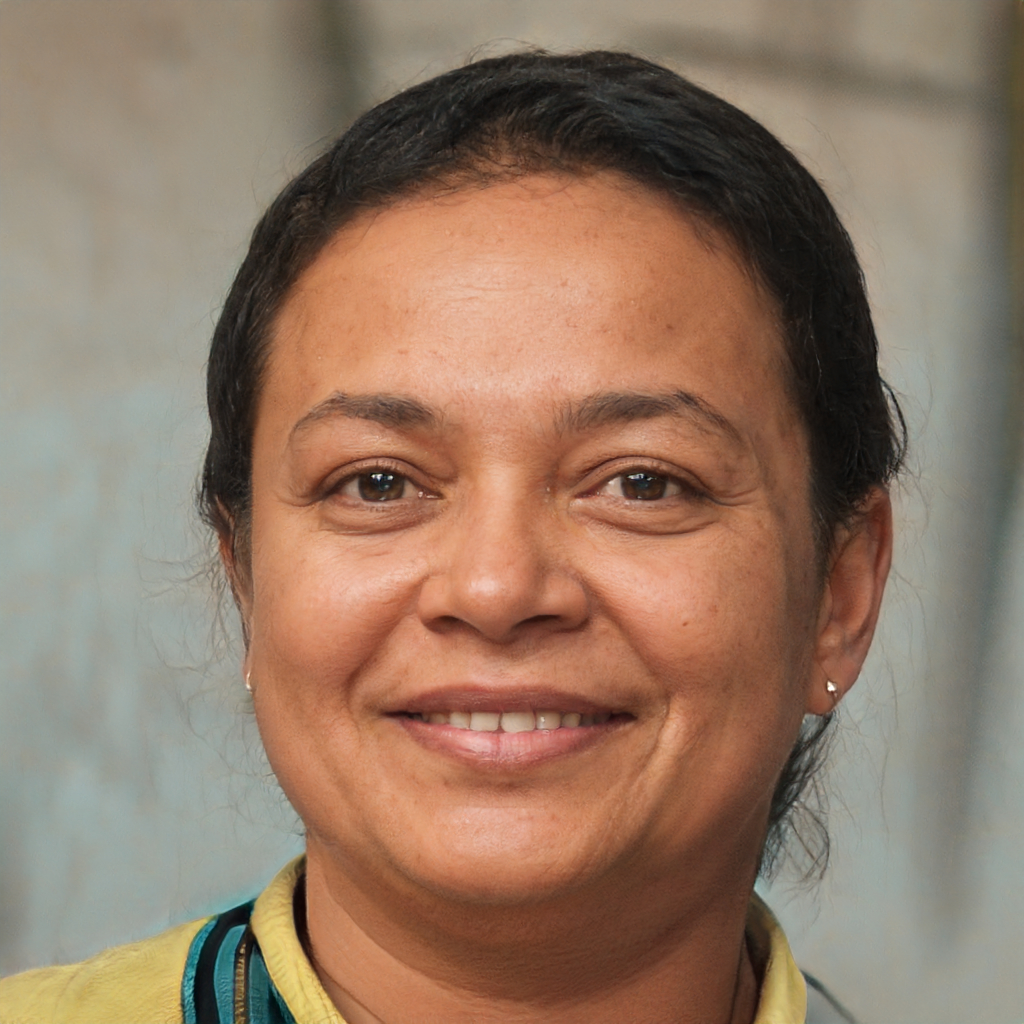Qual é o pH de uma solução de acetato de sódio 0.150 M (NaO2CCH3)? Ka (CH3CO2H) = 1.8 x 10-5.
Responda:
O pH é aproximadamente 8.96.
Explicação:
Acetato de sódio é o sal de um ácido fraco e uma base forte da equação:
#C_(2)H_(3)NaO_2->CH_3COO^(-)+Na^(+)#, Onde: #CH_3COO^(-)+H_2O\rightleftharpoonsCH_3COOH+OH^(-)#
Como é um ácido fraco e uma base forte, este é um bom indicador de um pH bastante alto.
#K_b=([HB^+][OH^-])/([B])# em que:
- #[B]# é a concentração da base
- #[HB^+]# é a concentração de íons base.
- #[OH^-]# é a concentração dos íons hidróxido.
Tb, #K_aK_b=1*10^(-14)#/ Tão, #K_b=(1*10^(-14))/(1.8*10^(-5))=5.555...*10^(-10)#
#[("",CH_3COO^(-),CH_3COOH,OH^-),(I,0.150,0,0),(C,-x,+x,+x),(E,0.150-x,x,x)]#
#K_b=5.555...*10^(-10)=x^2/(0.150-x)#
Como o valor para #K_b# for pequeno, assumiremos o valor para #x# é pequeno e, portanto, levará #0.150#.
Assim, #x=sqrt(0.150(5.555...*10^(-10)))=OH^-#
#pH=14-pOH=14-(-log(OH^-))#
#=14-(-log(sqrt(0.150(5.555...*10^(-10)))))#
#=14-(-log(9.128709292*10^(-6)))#
#=14-5.039590623~~8.96#