Como posso determinar se e quando uma molécula tem ou precisa de uma estrutura de ressonância?
Responda:
Uma molécula pode ter estruturas de ressonância quando possui um par solitário ou uma ligação dupla no átomo ao lado de uma ligação dupla.
Explicação:
Sempre que você pode desenhar duas ou mais estruturas de Lewis para uma molécula, diferindo apenas nas localizações dos elétrons, a estrutura real não é uma das estruturas, mas é uma ressonância híbrido de todos eles.
Por exemplo, qual é a estrutura de Lewis do íon nitrito, NO₂⁻?
1. Decida qual é o átomo central na estrutura. Normalmente, esse será o átomo menos eletronegativo (N).
2. Desenhe uma estrutura esquelética na qual os outros átomos estejam unidos ao átomo central: ONO.
3. Desenhe uma estrutura de teste colocando pares de elétrons em torno de cada átomo até que cada um obtenha um octeto. Neste editor, terei que escrevê-lo como :: Ö-N (::) - Ö ::
4. Conte o elétrons de valência na sua estrutura de avaliação (20).
5. Agora conte o elétrons de valência você realmente tem disponível.
1 N + 2 O + 1 = 1 × 7 + 2 × 6 + 1 = 18.
A estrutura de teste possui mais dois elétrons do que os disponíveis.
6. Desenhe uma nova estrutura de teste, desta vez inserindo uma ligação dupla para cada par extra de elétrons: ON = O e O = NO (duas possibilidades) - Aqui, as duas possibilidades nos dizem que teremos duas estruturas de ressonância.
7. Como antes, adicione elétrons de valência para dar a cada átomo um octeto:
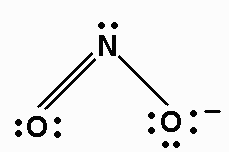
8. Atribuir cargas formais a cada átomo.
Cada átomo "possui" seus pares de elétrons solitários e metade dos pares compartilhados.
O átomo O do lado direito possui elétrons de pares solitários 6 mais 1 da ligação simples. Este é mais um elétron do que em um átomo de O isolado. Portanto, a cobrança formal em O é -1.
As duas estruturas de ressonância são:

A estrutura atual não é nenhuma delas. É um híbrido de ressonância dos dois.


