Como você conhece os orbitais híbridos de um composto? Por exemplo, quais são os orbitais híbridos de # CH_2Cl_2 #, # C_2H_4 # e # C_2H_2 #?
Responda:
Os orbitais híbridos em #"CH"_2"Cl"_2, "C"_2"H"_4#e #"C"_2"H"_2# estão #"sp"^3, "sp"^2^#e #"sp"#, Respectivamente.
Explicação:
Em cada caso, você deve desenhar a estrutura de Lewis, determinar a geometria do VSEPR e atribuir a hibridação correspondente.
#"CH"_2"Cl"_2#:
A estrutura de Lewis #"CH"_2"Cl"_2# is

Existem quatro domínios de elétrons ao redor do átomo de carbono, a geometria eletrônica é tetraédrico.

A hibridação que corresponde a uma geometria tetraédrica é #"sp"^3#.

#"C"_2"H"_4#:
A estrutura de Lewis #"C"_2"H"_4# is
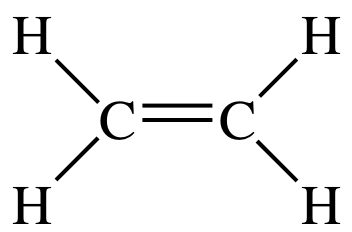
Existem três domínios de elétrons ao redor de cada átomo de carbono, então a geometria do elétron é planar trigonal.
A hibridação que corresponde a uma geometria planar trigonal é #"sp"^2#.

#bb"sp"#
A estrutura de Lewis #"C"_2"H"_2# is

Existem dois domínios de elétrons ao redor de cada átomo de carbono, então a geometria do elétron é linear.

A hibridação que corresponde a uma geometria planar trigonal é #"sp"#.

(De Learnnext)

