Como você determinaria a energia de ionização de um átomo de hidrogênio (em kJ / mol) se o elétron estiver em seu estado fundamental?
Responda:
Vou sugerir duas maneiras de fazer isso.
Explicação:
#color(blue)((1))#
Use a expressão Rydberg:
O comprimento de onda #lambda# da linha de emissão no espectro de hidrogênio é dada por:
#1/lambda=R[1/n_1^(2)-1/n_2^2]#
#R# é a constante de Rydberg e tem o valor #1.097xx10^(7)"m"^(-1)#
#n_1# é o número quântico principal do nível de energia mais baixo
#n_2# é o número quântico principal do nível de energia mais alto.
Os níveis de energia no hidrogênio convergem e coalescem:

Desde que o elétron está no #n_1=1# No estado fundamental, precisamos considerar a série 1. Essas transições ocorrem na parte uv do espectro e são conhecidas como The Lyman Series.
Você pode ver isso como o valor de #n_2# aumenta então o valor de #1/n_2^2# diminui. Em valores cada vez mais altos, a expressão tende a zero até que em #n=oo# podemos considerar que o elétron deixou o átomo resultando em um íon.
A expressão Rydberg agora se torna:
#1/lambda=R[1/n_1^2-0]=R/n_1^2#
Desde #n_1=1# isso se torna:
#1/lambda=R#
#:.1/lambda=1.097xx10^7#
#:.lambda=9.116xx10^(-8)"m"#
Agora podemos encontrar a frequência e, portanto, a energia correspondente:
#c=nulambda#
#:.nu=c/lambda=(3xx10^(8))/(9.116xx10^-8)=3.291xx10^(15)"s"^(-1)#
Agora podemos usar a expressão Planck:
#E=hnu#
#:.E=6.626xx10^(-34)xx3.291xx10^15=2.18xx10^(-18)"J"#
Essa é a energia necessária para remover o elétron 1 do átomo de hidrogênio 1. Para encontrar a energia necessária para ionizar a mole de átomos H 1, multiplicamos pela constante Avogadro:
#E=2.18xx10^(-18)xx6.02xx10^23=13.123xx10^5"J""/""mol"#
#color(red)(E=1312" ""kJ/mol")#
#color(blue)((2))#
Use o limite de convergência do espectro uv em um método experimental.
Você pode ver no diagrama que os níveis de energia convergem e coalescem em um continuum. Isso significa que as linhas de emissão também convergirão.
A frequência com que isso acontece pode nos dar a energia de ionização.
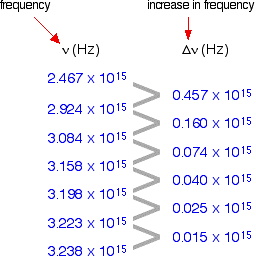
A coluna 1st mostra a frequência da linha.
A segunda coluna mostra a diferença de frequência que está ficando cada vez menos.
Se você planejar #nu# contra #Deltanu# você obtém um gráfico como este:
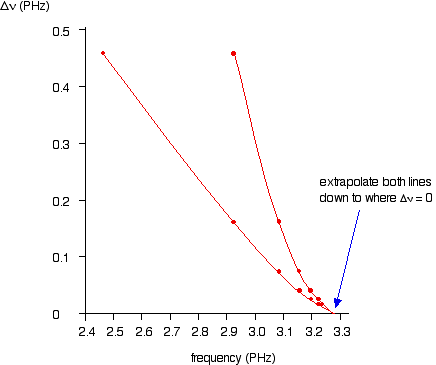
Você pode realmente obter linhas 2 usando valores superiores e inferiores. O ponto importante é que eles convergem para o mesmo ponto em que #Deltanu# tende a zero.
Você pode ler o limite de convergência fora do eixo x.
Isto dá #nu=3.28xx10^(15)"s"^(-1)# que é muito próximo do valor do método #color(blue)((1))#.
Como no método #color(blue)((1))# podemos converter para Joules usando a expressão Planck:
#E=hnu=6.626xx10^(-34)xx3.28xx10^(15)=2.173xx10^(-18)" ""J"#
Assim, para a toupeira 1:
#E=2.173xx10^(-18)xx6.02xx10^(23)=13.08xx10^(5)"J/mol"#
#color(red)(E=1308" ""kJ/mol")#

