Como você encontraria o número atômico, massa atômica, prótons, nêutrons e elétrons para íons e isótopos? É semelhante?
Responda:
Você usa a Tabela Periódica para obter as informações necessárias.
Explicação:
O símbolo para um isótopo de um elemento como #"O"# é frequentemente escrito como #""_8^16"O"^n#.
-
O #"O"# é, obviamente, o símbolo de um átomo de oxigênio.
-
O subscrito representa o número atômico #Z#, o número de prótons no núcleo.
-
O sobrescrito superior esquerdo representa o Número de massa #A#, o número total de prótons e nêutrons no núcleo.
-
O sobrescrito superior direito representa a carga no íon (por exemplo, + 1 ou -2).
-
Se não houver sobrescrito no canto superior direito, a carga será zero e teremos um átomo neutro.
Quantos prótons, nêutrons e elétrons estão em um átomo de mercúrio - 201?
Primeiro, você deve encontrar o elemento no Tabela periódica.
Todas as tabelas periódicas fornecem pelo menos o símbolo e o número atômico do elemento.
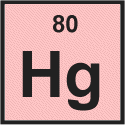
Vemos que, para mercúrio, o número atômico é 80.
O número atômico é o número de prótons no núcleo de um átomo, então podemos dizer imediatamente que um átomo de mercúrio contém Protões 80.
O número de massa (201) é o número total de prótons e nêutrons.
Portanto, deve haver 201 - 80 = Nêutrons 121.
Como os átomos são eletricamente neutros, deve haver tantos elétrons quanto prótons.
Um átomo de mercúrio precisa Elétrons 80 para equilibrar os prótons 80.
Em resumo:
- Nº de prótons = número atômico #Z#
- No. de elétrons = número atômico #Z#
- No. de nêutrons = número de massa - número atômico = #A – Z#
Quantos prótons, nêutrons e elétrons estão presentes #""_80^200"Hg"^(2+)#?
Aqui temos Protões 80 e 200 - 80 = Nêutrons 120.
A carga "2 +" nos diz que perdemos dois elétrons.
Portanto, existem 80 - 2 = Elétrons 78.
Assim, o processo é semelhante para isótopos e íons.

