O que é uma solução supersaturada?
A solução supersaturada contém mais soluto a uma dada temperatura do que é necessário para formar uma solução saturada.
O aumento da temperatura geralmente aumenta a solubilidade dos sólidos nos líquidos.
Por exemplo, a solubilidade da glicose a 25 ° C é 91 g / 100 mL de água. A solubilidade a 50 ° C é 244 g / 100 mL de água.
Se adicionarmos 100 g de glicose a 100 mL de água a 25 ° C, o 91 g se dissolverá. Restam nove gramas de sólido no fundo. Temos uma solução saturada.
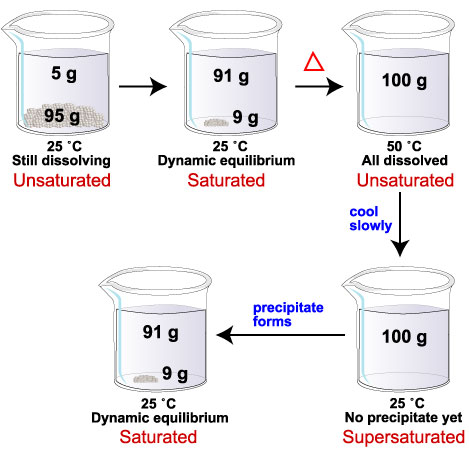
Se agora aquecermos a mistura a 50 ° C, o restante 9 g de glicose se dissolverá. À nova temperatura, o limite de solubilidade em 100 mL de água é 244 g de glicose. Com apenas 100 g de glicose dissolvida, a solução agora não é saturada.
Se, em seguida, esfriarmos a mistura de volta a 25 ° C, o 9 g de glicose deve precipitar da solução.
Se os cristais de glicose não se formarem, o sistema possui mais glicose dissolvida (100 g) do que pode suportar a 25 ° C (91 g). Temos uma solução supersaturada.
O primeiro passo na formação de cristais é nucleação. É quando as moléculas de soluto se organizam para formar cristais.
Às vezes isso acontece de uma vez. Caso contrário, temos uma solução supersaturada. Esta é uma situação instável.
Um pedaço de poeira ou um pequeno cristal do soluto, um cristal de semente, fornece um modelo para a cristalização do excesso de soluto. O excesso de soluto começa a formar cristais nos núcleos.
Quando os cristais começam a se formar, sua área de superfície aumenta à medida que crescem. Isso atrai mais moléculas e promove o crescimento a uma taxa cada vez maior. Finalmente, a solução se estabiliza e não mais cristais podem se formar.

