Que base (s) conjugada (s) desprotonará a água?
Responda:
A base conjugada de qualquer ácido com um #pK_"a"# maior que a água desprotonará a água.
Explicação:
Aqui está um pequeno #pK_"a"# tabela.
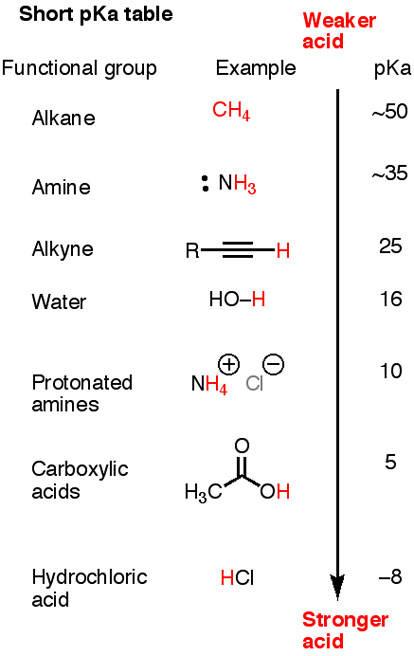
Observe que #"HC≡C-H", "H"_2"N-H"#e #"H"_3"C-H"# são ácidos mais fracos que a água.
As bases conjugadas correspondentes, #"H-C≡C:"^"-", "H"_2"N:"^"-"#e #"H"_3"C:"^"-"#, É forte. Todos eles desprotonam a água.
A base conjugada de metano #"H"_3"C:"^"-"# é forte o suficiente para desprotonar qualquer coisa abaixo dela na tabela.
Metil-lítio, #"CH"_3"Li"#, é uma das bases mais fortes do mercado.
Íon acetileto (#"H-C≡C:"^"-"#) é forte o suficiente para desprotonar apenas um ácido com um #"pK"_"a" < 25#.
Íon acetato (#"CH"_3"COO"^"-"#) é ainda mais fraco, capaz de desprotonar apenas um ácido com um #pK_a < 5#.
Uma tabela mais completa de #pK_"a"# Os valores fornecerão muito mais bases conjugadas que desprotonarão a água.

