Como você desenha células galvânicas?
Você desenha o ânodo, o cátodo, os agentes oxidantes e redutores, uma placa porosa ou uma ponte de sal. Você mostra a direção do fluxo de elétrons no circuito externo e o fluxo de íons no circuito interno.
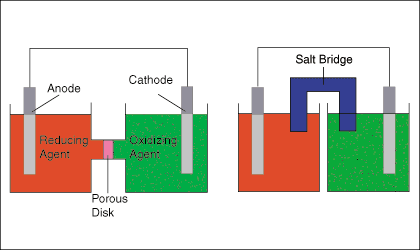
EXEMPLO:
Esboce um diagrama de células para a reação
Zn (s) + Cu²⁺ (aq) → Zn²⁺ (aq) + Cu (s)
Solução:
A. Desenhe um dos diagramas acima (sem etiquetas).
B. Identifique o que é oxidado e reduzido.
Zn é oxidado; Cu²⁺ é reduzido.
C. Coloque os materiais de oxidação na célula esquerda. Rotule o Zn como o ânodo negativo. Na solução, coloque Zn² e NO.
D. Coloque os materiais de semi-reação de redução na célula direita. Rotule o Cu como o cátodo positivo. Na solução, coloque Cu²⁺ e SO₄²⁻ ou NO₃⁻.
E. Coloque um sal como KNO₃ na ponte de sal.
F. Use as setas para mostrar o fluxo de elétrons no fio externo.

G. Mostre o fluxo de íons no circuito interno.
Os cátions - Zn², Na⁺ e Cu²⁺ - movem-se da esquerda para a direita. Os ânions NO₃⁻ se movem da direita para a esquerda. Desenhe setas para mostrar esses movimentos.

