Quais são as reações para aminas e amidas?
Uma amina é um composto orgânico, relacionado à amônia, que contém um átomo de nitrogênio ligado a um ou mais grupos alquil em cada molécula

#"Primary amine"#

#"an example of Secondary amine"#

#"Tertiary amine"#

Os átomos de nitrogênio que fazem parte de um anel aromático têm configuração planar (configuração sp2) e não centros estereogênicos. Por causa das aminas de aromacidade nos anéis aromáticos, é estável.
Como a hibridação do nitrogênio, afeta seu poder como ácido e base.
Um caráter mais alto do nitrogênio torna o composto ácido, por exemplo, na piridina e nos nitrilos.
Em segundo lugar, a anilina e a p-nitroanilina são bases mais fracas devido à deslocalização do par de elétrons não ligados ao nitrogênio no anel aromático (e no substituinte nitro). Essa é a mesma deslocalização que resulta na ativação de um anel de benzeno em direção à substituição eletrofílica.
As seguintes equações de ressonância, que são semelhantes às usadas para explicar a acidez aumentada de orto e para-nitrofenóis, ilustram a deslocalização de pares de elétrons na p-nitroanilina.
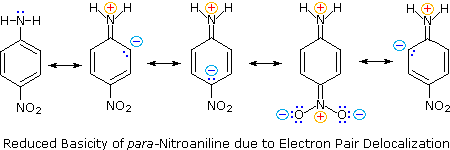
Embora a deslocalização da ressonância geralmente reduza a basicidade das aminas, um exemplo dramático do efeito reverso é encontrado no composto guanidina (pKa = 13.6).
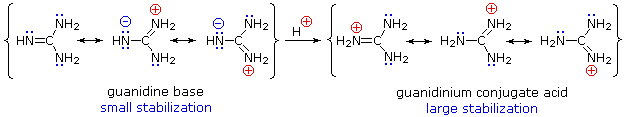
As aminas são principalmente básicas, mas algumas reduziram a basicidade por esses motivos
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Quando reagidas com ácidos, as aminas doam elétrons para formar sais de amônio.

Os halogenetos ácidos reagem com aminas para formar amidas substituídas

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Produção de bases Schiff a partir de aminas primárias
Aldeídos e cetonas reagem com aminas primárias para produzir um produto de reação (uma carbinolamina) que desidrata para produzir aldiminas e cetiminas (bases de Schiff)

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Se você reagir aminas secundárias com aldeídos ou cetonas, as enaminas se formam.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
As aminas reagem com cloretos de sulfonil para produzir sulfonamidas. Um exemplo típico é a reação do cloreto de benzeno sulfonil com anilina.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
O teste de Hinsberg
O teste de Hinsberg, que pode distinguir aminas primárias, secundárias e terciárias, baseia-se na formação de sulfonamida. No teste de Hinsberg, uma amina é reagida com cloreto de benzeno sulfonil. Se um produto se formar, a amina é uma amina primária ou secundária, porque as aminas terciárias não formam sulfonamidas estáveis. Se a sulfonamida que se dissolve em solução aquosa de hidróxido de sódio, é uma amina primária. Se a sulfonamida é insolúvel em hidróxido de sódio aquoso, é uma amina secundária. A sulfonamida de uma amina primária é solúvel em uma base aquosa porque ainda possui um hidrogênio ácido no nitrogênio, que pode ser perdido para formar um sal de sódio.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Oxidação de aminas
Embora você possa oxidar todas as aminas, apenas as aminas terciárias fornecem produtos facilmente isolados. A oxidação de uma amina terciária leva à formação de um óxido de amina.

As arilaminas tendem a ser facilmente oxidadas, ocorrendo oxidação no grupo amina e no anel.
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Reação com ácido nitroso
O ácido nitroso é instável e deve ser preparado na solução da reação misturando nitrito de sódio com ácido.
As aminas primárias reagem com o ácido nitroso para produzir um sal de diazônio, que é altamente instável e se degrada em um carbococo capaz de reagir com qualquer nucleófilo em solução. Portanto, a reação de aminas primárias com ácido nitroso leva a uma mistura de álcool, alcenos e halogenetos de alquila.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
As aminas aromáticas primárias formam sais de diazônio estáveis a zero grau.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
As aminas alifáticas e aromáticas secundárias formam nitrosoamina com ácido nitroso.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
As aminas terciárias reagem com ácido nitroso para formar compostos de N-nitrosoamônio.

#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)# #color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
#color(white)(cccccccccccccccccccccccccccccccccccccccccccc)#
Reações de sais aromáticos de diazônio
Os sais de diazônio das aminas aromáticas são muito úteis como intermediários para outros compostos. Como os sais aromáticos de diazônio são estáveis apenas a temperaturas muito baixas (zero graus e abaixo), o aquecimento desses sais inicia a decomposição em cátions altamente reativos. Estes cátions podem reagir com qualquer ânion presente na solução para formar uma variedade de compostos. A figura a seguir ilustra a diversidade das reações.

Vou escrever sobre amidas em outra resposta a esta pergunta

