Teoria do VBT prevê hibridação OU derivar hibridação da teoria do VSEPR O VBT explica a ligação com relação ao VSEPR - não esperava a hibridação H2O SP3 devido ao vespr e não vbt espera em segundo porque não há hibridação no HF para explicação do VBT?
Responda:
Aqui está a minha resposta para o que eu acho que você está perguntando.
Explicação:
Teoria da ligação de valência
Teoria de Valence Bond (VB) é baseado em elétrons de valência. Nós o usamos para ajudar a determinar a estrutura de uma molécula.
Começamos com a estrutura de Lewis de uma molécula e depois explicamos a formação de ligações pela sobreposição de orbitais atômicos.
Se nosso uso de orbitais atômicos simples não explica a forma observada de uma molécula, então recorremos ao conceito de orbitais atômicos hibridizados.
Teoria VB e #"HF"#
A estrutura de Lewis #"HF"# is

O configuração eletrônica of #"H"# is #"1s"#e a configuração eletrônica de valência de #"F"# is #"[He] 2s"^2"2p"_text(x)^2"2p"_text(y)^2"2p"_text(z)#.
Assim, explicamos a #"H-F"# formação de ligações pela sobreposição do hidrogênio #"1s"# orbital com o flúor meio cheio #"2p"# orbital para formar uma ligação σ.
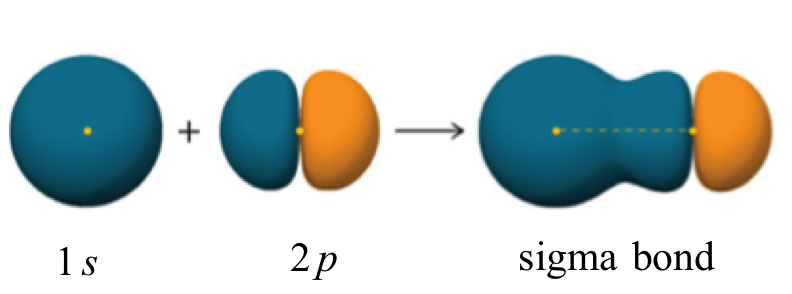
Como existem apenas dois átomos, a molécula é linear e não precisamos usar hibridação para explicar sua forma.
Teoria VB e #"H"_2"O"#
A estrutura de Lewis #"H"_2"O"# is
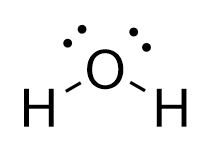
A configuração eletrônica de valência de #"O"# is #"[He] 2s"^2"2p"_text(x)^2"2p"_text(y)"2p"_text(z)#.
Assim, poderíamos explicar a #"OH"# formação de ligações pela sobreposição do hidrogênio #"1s"# orbital com o oxigênio meio cheio #"2p"# orbitais para formar duas ligações σ.
O problema é que isso prevê a #"H-O-H"# ângulo de ligação seja 90 °, e o ângulo de ligação observado é 104.5 °.
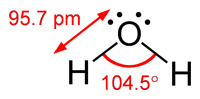
VSEPR teoria fornece uma melhor previsão do ângulo de união.
Os quatro pares de elétrons se repelem aos quatro cantos de um tetraedro, para os quais o ângulo de ligação teórico é 109.5 °.
Os quatro hibridizados #"sp"^3# orbitais também prevêem um ângulo de ligação de 109.5 °.
Explicamos a diferença de 5 ° da teórica como resultante da repulsão pelos elétrons do par solitário.


