BeCl_2 e TeCl_2 são moléculas covalentes, mas BeCl_2 é linear enquanto TeCl_2 é dobrado. Por quê?
"TeCl"_2: A Central "Te" átomo tem 6 elétrons de valência. Quando os dois "Cl" átomos se ligam ao átomo central, cada um deles contribui com um elétron para formar dois ligações sigma. Isso deixa 4 elétrons nos átomos centrais na forma de 2 pares de elétrons solitários.
Este é o VSEPR forma "AX"_2"E"_2, uma forma de tetraedro com dois pares de elétrons e dois átomos, criando uma forma molecular dobrada.
![]()
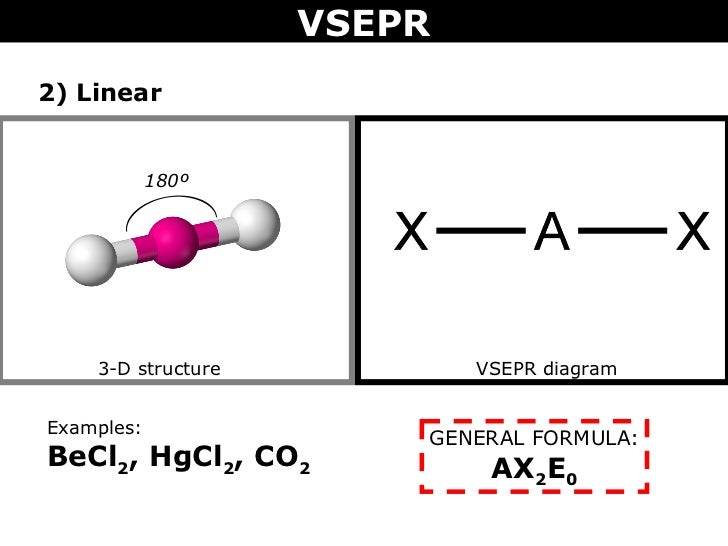
"BeCl"_2por outro lado, tem "Be" como seu átomo central. Desde a "Be" só tem 2 elétrons de valência, as duas ligações sigma formadas pelo "Cl" átomos deixam "Be" sem pares solitários.
A forma VSEPR é "AX"_2"E"_0 e forma uma forma linear.