Calcule o número de colisões por segundo de uma molécula de hidrogênio a 24 ° C e 2.00 bar. O diâmetro de uma molécula de hidrogênio é 270 pm?
Responda:
ATENÇÃO! Resposta longa! Tem 3.46 × 10^103.46×1010 colisões por segundo.
Explicação:
De acordo com a Teoria Molecular Cinética, a frequência de colisão é igual à velocidade da raiz quadrada média das moléculas dividida pelo seu caminho livre médio.
color(blue)(bar(ul(|color(white)(a/a)ν = v_"rms"/λcolor(white)(a/a)|)))" "
Velocidade raiz quadrada média
A fórmula que relaciona a velocidade eficaz à temperatura e massa molar é:
color(blue)(bar(ul(|color(white)(a/a) v_"rms" = sqrt((3RT)/M)color(white)(a/a)|)))" "
onde
R = constante de gás universal
T = a temperatura
M = massa molar
Para se qualificar para o "H"_2 a 24 ° C,
T = "(24 + 273.15) K" = "297.15 K"
M = "2.016 g·mol"^"-1" = 2.016 × 10^"-3"color(white)(l) "kg·mol"^"-1"
v_"rms" = sqrt((3RT)/M) = sqrt((3 × 8.314 color(red)(cancel(color(black)("J·K"^"-1""mol"^"-1"))) × 297.15 color(red)(cancel(color(black)("K"))))/( 2.016 × 10^"-3" color(red)(cancel(color(black)("kg·mol"^"-1")))) × ( 1 color(red)(cancel(color(black)("kg")))·"m"^2"s"^"-2")/(1 color(red)(cancel(color(black)("J"))))) = = "1917 m·s"^"-1"
O caminho livre médio
Se as moléculas têm diâmetro d, então podemos usar um círculo de diâmetro σ = 2d para representar uma molécula área de colisão efetiva.
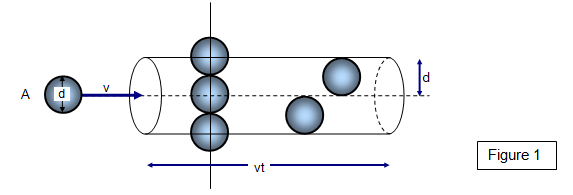
Para uma molécula de hidrogênio, σ = "289 pm".
A fórmula para o caminho livre médio é
color(blue)(bar(ul(|color(white)(a/a) λ = (RT)/(sqrt2πσ^2N_"A"P)color(white)(a/a)|)))" "
R = 0".083 14 bar·L·K"^"-1""mol"^"-1" = 8.314 × 10^"-5"color(white)(l)"bar·m"^3·"K"^"-1""mol"^"-1"
T = "297.15 K"
σ = "289 pm" = 289 × 10^"-12"color(white)(l) "m"
N_"A" = 6.022 × 10^23color(white)(l) "mol"^"-1"
P = "2.00 bar"
λ = (RT)/(sqrt2πσ^2N_"A"P) = (8.314 × 10^"-5"color(red)(cancel(color(black)("bar")))·stackrelcolor(blue)("m")(color(red)(cancel(color(black)("m"^3))))·color(red)(cancel(color(black)("K"^"-1""mol"^"-1"))) × 297.15 color(red)(cancel(color(black)("K"))))/(sqrt2π × (289 × 10^"-12" color(red)(cancel(color(black)("m"))))^2 × 6.022 × 10^23 color(red)(cancel(color(black)("mol"^"-1"))) × 2.00 color(red)(cancel(color(black)("bar"))))
= 5.52 × 10^"-8"color(white)(l) "m" = "55.2 nm"
Frequência de colisão
ν = v_"rms"/λ = (1917 color(red)(cancel(color(black)("m")))·"s"^"-1")/(5.52 × 10^"-8" color(red)(cancel(color(black)("m")))) = 3.46 × 10^10color(white)(l) "s"^"-1"

