Como determino a hibridação e ligação na amônia?
Responda:
Aqui está como fazê-lo.
Explicação:
Você desenha a estrutura de Lewis (Etapa 1) e usa VSEPR teoria para determinar sua geometria de domínio eletrônico como tetraédrica e sua forma molecular (Etapa 2) como uma pirâmide trigonal.
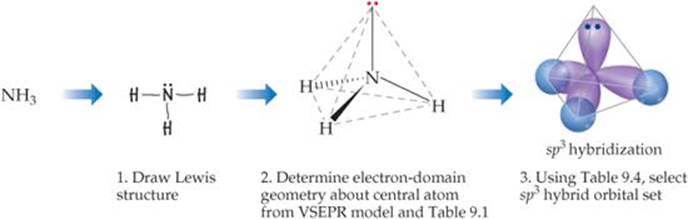
Depois, consulte uma tabela como a abaixo.

(Adaptado do SlideShare)
Você acha que o "N" átomo usa "sp"^3 orbitais, para que você desenhe quatro formas de lágrima apontando para os cantos de um tetraedro (Etapa 3).
O "H" átomos usam sua "1s" orbitais para ligação, então você desenha pequenos círculos que se cruzam com três dos "sp"Orbitais 3.
Isso mostra que o "N-H" obrigações são obrigações formadas pela sobreposição de "sp"^3 orbitais de "N" e "1s" orbitais de "H".
No entanto, os orbitais moleculares incluem tanto a "N" e "H" núcleos.

No diagrama acima, o desenho da linha de ligação mostra que o "H" núcleos estão completamente dentro do maior em forma de lágrima "sp"^3"-s" σ orbitais moleculares.

