O que são orbitais s, p, d, f?
Responda:
Orbitais são as regiões do espaço em que os elétrons são mais prováveis de serem encontrados.
Explicação:
Cada orbital é indicado por um número e uma letra.
O número indica o nível de energia do elétron no orbital. Assim, 1 refere-se ao nível de energia mais próximo do núcleo; 2 refere-se ao próximo nível de energia mais adiante, e assim por diante.
A letra refere-se à forma do orbital. As letras são da ordem s, p, d, f, g, h, i, j, etc. As letras s, p, d e f foram atribuídas por razões históricas que não precisam nos interessar. Tudo o que precisamos fazer é lembrar as formas que correspondem a cada letra.
Como um elétron pode teoricamente ocupar todo o espaço, é impossível desenhar um orbital. Tudo o que podemos fazer é desenhar uma forma que inclua o elétron na maioria das vezes, digamos 95% do tempo. Chamamos essa forma de contorno 95%.
s ORBITOS
Um orbital s é esfericamente simétrico ao redor do núcleo do átomo, como uma bola oca feita de material bastante macio com o núcleo no centro. À medida que os níveis de energia aumentam, os elétrons ficam mais afastados do núcleo, assim os orbitais aumentam. A ordem do tamanho é 1s <2s <3s <…, conforme mostrado abaixo.
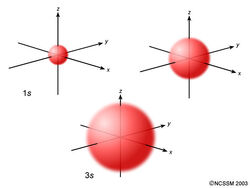
Agora, vejamos uma seção transversal desses orbitais.

Se você olhar com atenção, notará que um orbital 1s tem muito pouco elétron densidade próximo ao núcleo, mas aumenta até o máximo à medida que você se afasta do núcleo e depois diminui além do contorno. É como uma bola de tênis vazia.
Um orbital 2s é semelhante a um orbital 1s, mas possui uma esfera de densidade de elétrons dentro da esfera externa, como uma bola de tênis dentro de outra. Existe uma superfície entre as duas esferas, onde não há probabilidade de encontrar um elétron. Chamamos essa superfície de nó ou superfície nodal.
Um orbital 3s é ainda maior e possui três nós.
p ORBITOS
Nem todos os elétrons habitam os orbitais. No primeiro nível de energia, o único orbital disponível para os elétrons é o orbital 1s. No entanto, no segundo nível, também existem orbitais chamados orbitais 2p, além do orbital 2s.
Diferentemente de um orbital s, ap orbital aponta em uma direção específica. O mostrado abaixo aponta para cima e para baixo na página.

Em qualquer nível de energia, temos três orbitais p absolutamente equivalentes, apontando mutuamente perpendiculares um ao outro. Estes são arbitrariamente dados os símbolos px, py e pz. Isso é simplesmente por conveniência, porque o que você pode pensar como a direção x, y ou z muda constantemente à medida que o átomo cai no espaço.
Os orbitais p no segundo nível de energia são chamados 2px, 2py e 2pz. Existem orbitais semelhantes nos níveis subseqüentes: 3px, 3py, 3pz, 4px, 4py, 4pz e assim por diante.
Todos os níveis, exceto o primeiro, têm orbitais p.

d ORBITOS
Além dos orbitais sep, existem outros dois conjuntos de orbitais disponíveis para os elétrons habitarem em níveis mais altos de energia. No terceiro nível, há um conjunto de cinco orbitais d (com formas e nomes complicados), bem como os orbitais 3s e 3p (3px, 3py, 3pz). No terceiro nível, há um total de nove orbitais no total.
Os cinco orbitais 3d são chamados
3dxy
3dxz
3dyz
3dx² - y²
3dz²

Para entender os nomes, precisamos examiná-los em dois grupos. O primeiro grupo contém os orbitais 3dxy, 3dxz e 3dyz. Os nomes dizem que esses orbitais estão no plano xy, no plano xz e no plano yz, respectivamente. Cada orbital possui quatro lóbulos e cada um deles aponta entre dois eixos, não ao longo deles.
O segundo grupo contém os orbitais 3dx² - y² e 3dz². Seus lobos apontam ao longo dos vários eixos.
O orbital 3dx² - y² se parece exatamente com o primeiro grupo, exceto pelo fato de os lobos estarem apontando ao longo dos eixos xey, não entre eles.
O 3dz² parece um orbital usando uma rosquinha na cintura.
f ORBITOS
No quarto e mais alto níveis, existem sete orbitais f, além dos orbitais 4s, 4p e 4d.
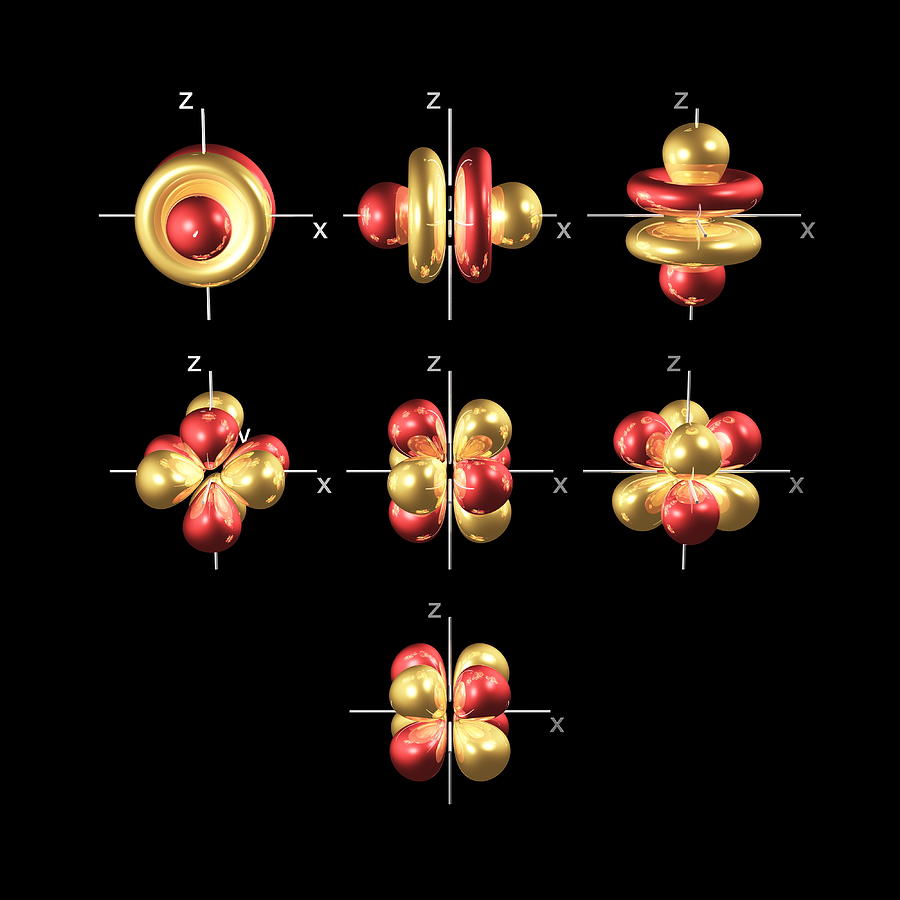
Contando os orbitais 4s, 4p e 4d, isso perfaz um total de orbitais 16 no quarto nível. Eles têm formas ainda mais complicadas. Os orbitais s, p, d e f também estão disponíveis em todos os níveis de energia mais altos. Felizmente, você provavelmente não precisará memorizar as formas dos orbitais f. Lembre-se de que existem sete orbitais f em cada nível, do nível 4 em diante.

