Quais são as reações para aminas e amidas?
Uma amina é um composto orgânico, relacionado à amônia, que contém um átomo de nitrogênio ligado a um ou mais grupos alquil em cada molécula

"Primary amine"

"an example of Secondary amine"

"Tertiary amine"

Os átomos de nitrogênio que fazem parte de um anel aromático têm configuração planar (configuração sp2) e não centros estereogênicos. Por causa das aminas de aromacidade nos anéis aromáticos, é estável.
Como a hibridação do nitrogênio, afeta seu poder como ácido e base.
Um caráter mais alto do nitrogênio torna o composto ácido, por exemplo, na piridina e nos nitrilos.
Em segundo lugar, a anilina e a p-nitroanilina são bases mais fracas devido à deslocalização do par de elétrons não ligados ao nitrogênio no anel aromático (e no substituinte nitro). Essa é a mesma deslocalização que resulta na ativação de um anel de benzeno em direção à substituição eletrofílica.
As seguintes equações de ressonância, que são semelhantes às usadas para explicar a acidez aumentada de orto e para-nitrofenóis, ilustram a deslocalização de pares de elétrons na p-nitroanilina.
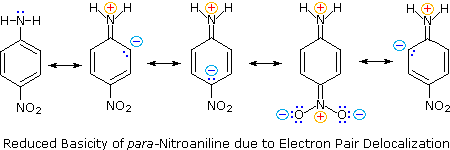
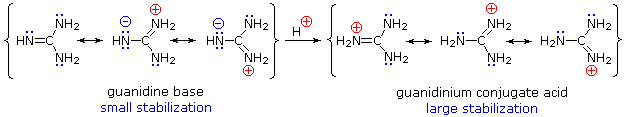
Embora a deslocalização da ressonância geralmente reduza a basicidade das aminas, um exemplo dramático do efeito reverso é encontrado no composto guanidina (pKa = 13.6).
As aminas são principalmente básicas, mas algumas reduziram a basicidade por esses motivos
color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
Quando reagidas com ácidos, as aminas doam elétrons para formar sais de amônio.

Os halogenetos ácidos reagem com aminas para formar amidas substituídas

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
Produção de bases Schiff a partir de aminas primárias
Aldeídos e cetonas reagem com aminas primárias para produzir um produto de reação (uma carbinolamina) que desidrata para produzir aldiminas e cetiminas (bases de Schiff)

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
Se você reagir aminas secundárias com aldeídos ou cetonas, as enaminas se formam.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
As aminas reagem com cloretos de sulfonil para produzir sulfonamidas. Um exemplo típico é a reação do cloreto de benzeno sulfonil com anilina.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
O teste de Hinsberg
O teste de Hinsberg, que pode distinguir aminas primárias, secundárias e terciárias, baseia-se na formação de sulfonamida. No teste de Hinsberg, uma amina é reagida com cloreto de benzeno sulfonil. Se um produto se formar, a amina é uma amina primária ou secundária, porque as aminas terciárias não formam sulfonamidas estáveis. Se a sulfonamida que se dissolve em solução aquosa de hidróxido de sódio, é uma amina primária. Se a sulfonamida é insolúvel em hidróxido de sódio aquoso, é uma amina secundária. A sulfonamida de uma amina primária é solúvel em uma base aquosa porque ainda possui um hidrogênio ácido no nitrogênio, que pode ser perdido para formar um sal de sódio.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
Oxidação de aminas
Embora você possa oxidar todas as aminas, apenas as aminas terciárias fornecem produtos facilmente isolados. A oxidação de uma amina terciária leva à formação de um óxido de amina.

As arilaminas tendem a ser facilmente oxidadas, ocorrendo oxidação no grupo amina e no anel.
color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
Reação com ácido nitroso
O ácido nitroso é instável e deve ser preparado na solução da reação misturando nitrito de sódio com ácido.
As aminas primárias reagem com o ácido nitroso para produzir um sal de diazônio, que é altamente instável e se degrada em um carbococo capaz de reagir com qualquer nucleófilo em solução. Portanto, a reação de aminas primárias com ácido nitroso leva a uma mistura de álcool, alcenos e halogenetos de alquila.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
As aminas aromáticas primárias formam sais de diazônio estáveis a zero grau.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
As aminas alifáticas e aromáticas secundárias formam nitrosoamina com ácido nitroso.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
As aminas terciárias reagem com ácido nitroso para formar compostos de N-nitrosoamônio.

color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc) color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
color(white)(cccccccccccccccccccccccccccccccccccccccccccc)
Reações de sais aromáticos de diazônio
Os sais de diazônio das aminas aromáticas são muito úteis como intermediários para outros compostos. Como os sais aromáticos de diazônio são estáveis apenas a temperaturas muito baixas (zero graus e abaixo), o aquecimento desses sais inicia a decomposição em cátions altamente reativos. Estes cátions podem reagir com qualquer ânion presente na solução para formar uma variedade de compostos. A figura a seguir ilustra a diversidade das reações.

Vou escrever sobre amidas em outra resposta a esta pergunta

