Quais são os principais e menores contribuidores de ressonância para o ânion azida, #N_3 ^ - #?
As etapas para desenhar as estruturas de Lewis são:
1. Escreva todas as conexões possíveis para os átomos de nitrogênio.
NNN
2. calculado#V#, o número de elétrons de valência você realmente tem disponível.
#V# = 3 N + 1 = 3 × 5 + 1 = 16.
3. calculado #P#, o número de elétrons π deve haver na molécula:
#P = 6n + 2 – V#
onde #n# é o número de átomos de hidrogênio na molécula.
#P# = 6 × 3 + 2 - 16 = 4 π elétrons. Portanto, existem duas ligações duplas ou uma ligação tripla.
4. Desenhe novas estruturas.
Desta vez, insira as ligações duplas e triplas em todas as combinações possíveis.
5. Adicione elétrons de valência para dar a cada átomo um octeto.
6. Calcule a carga formal em cada átomo.
Acabamos com as possibilidades do 3.
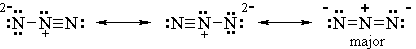
7. Identifique o principal colaborador.
Todas as três estruturas têm separação de carga.
As duas primeiras estruturas têm uma carga de 2- em um átomo de N. A terceira estrutura possui uma carga de -1 em dois átomos de N separados.
O colaborador mais estável terá a maior deslocalização ou propagação gratuita.
Portanto, as duas primeiras estruturas são contribuintes menores e a terceira é a principal.

