Que reação ocorre entre o césio e a água que o faz reagir com tanta violência?
O césio reage com água fria para formar gás hidrogênio e uma solução de íons césio e íons hidróxido.
2Cs + 2HUMO (l) → H) (g) + 2Cs⁺ (aq) + 2OH⁻ (aq)
A reação é tão explosiva que muitas vezes destrói o recipiente.
Podemos escrever as mudanças para o átomo de Cs como
(1) Cs (s) → Cs (g); ΔH_"sub" = + 79 kJ / mol
(2) Cs (g) → Cs⁺ (g); I_1 = + 375.7 kJ / mol
(3) Cs⁺ (g) → Cs⁺ (aq); ΔH_"hydr" = -276 kJ / mol
A energia de sublimação (1) é o menor dos metais alcalinos porque os átomos de Cs são os maiores.
À medida que os átomos aumentam, os pontos fortes das ligações metálicas diminuem. É preciso menos energia para colocar os átomos na fase de vapor.
A energia de ionização (2) é o menor dos metais alcalinos.
À medida que você desce pelo Grupo, o elétron de valência fica mais distante do núcleo e é rastreado por mais camadas de elétrons internos.
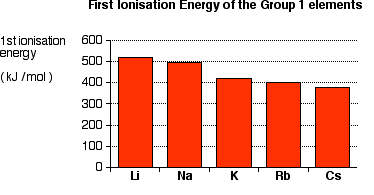
As etapas de entrada de energia (1) e (2) estão relacionadas à energia de ativação da reação. Portanto, a energia de ativação para Cs é a mais baixa, principalmente devido à sua baixa energia de ionização.
Quanto menor a energia de ativação, mais rápida a reação. Então o Cs reage extremamente rápido - e você recebe uma explosão.
Aqui está um vídeo mostrando a reação dos Cs com a água.

