Que tipo de forças intermoleculares estão presentes nos seguintes compostos: #C Cl_4 #, # CH_2Cl_2 #, # CH_3OH #, # CO_2 #, # SCl_4 # e # SCl_6 #?
Atenção! Resposta longa. Aqui está o que eu recebo.
Você precisa desenhar a estrutura de Lewis de cada molécula, usar a teoria VSEPR para determinar sua forma e depois decidir se a ligação dipolos cancelar.
#"CO"_2# e #"CCl"_4#

(Por www.peoi.org)
#"CO"_2# é uma molécula linear com um #"O-C-O"# ângulo de ligação de 180 °. Os dipolos de ligação são iguais e em direções opostas; portanto, eles são cancelados.
#"CO"_2# é uma molécula não polar. Suas forças intermoleculares mais fortes são Forças de dispersão de Londres.
#"CCl"_4# é uma molécula tetraédrica com um #"Cl-C-Cl"# ângulo de ligação de 109.5 °.
Os dois #"C-Cl"# dipolos de ligação no plano do papel têm como resultado apontar para a direita em um ângulo de 54.75 ° da vertical.
Os dois #"C-Cl"# dipolos bond atrás e na frente do papel têm um resultado igual e oposto ao primeiro.
Como os dipolos de ligação são iguais e em direções opostas, eles cancelam.
#"CCl"_4# é uma molécula não polar. Suas forças intermoleculares mais fortes são Forças de dispersão de Londres.
#"CH"_2"Cl"_2#
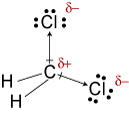
#"CH"_2"Cl"_2# tem uma forma tetraédrica. Os dois #"C-Cl"# dipolos de ligação têm uma resultante que corta o #"Cl-C-Cl"# ângulo de ligação.
#"CH"_2"Cl"_2# é, portanto, uma molécula polar, e suas forças intermoleculares mais fortes são forças dipolo-dipolo.
#"CH"_3"OH"#
#"CH"_3"OH"# tem um altamente polar #"O-H"# vinculo. o #"O"# átomo tem uma alta #δ^"-"# carga e o #"H"# do #"OH"# tem um alto #δ^+# carga.
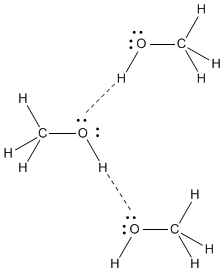
O #"O"# em uma molécula é fortemente atraído pelo #"H"# em outra molécula, e o #"H"# em uma molécula é fortemente atraído pelo #"O"# em outra molécula.
A força intermolecular mais forte da #"CH"_3"OH"# is ligação de hidrogênio.
#"SCl"_4#

(Por en.wikipedia.org)
#"SCl"_4# tem uma forma de gangorra.
Os dois horizontais #"S-Cl"# os dipolos de ligação cancelam, mas os dipolos que apontam para baixo se reforçam.
#"SCl"_4# é uma molécula polar, e suas forças intermoleculares mais fortes são forças dipolo-dipolo.
#"SCl"_6#
#"SCl"_6#é uma molécula octaédrica.
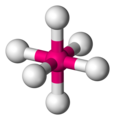
Cada #"S-Cl"# o dipolo de ligação tem um parceiro apontando exatamente na direção oposta; portanto, todos os dipolos de ligação são cancelados.
#"SCl"_6# é uma molécula não polar, então suas forças intermoleculares mais fortes são Forças de dispersão de Londres.

