Todas as seguintes moléculas contêm pelo menos um ângulo de ligação nos graus 120: SeS3, SeS2, PCl5, TeCl4, ICI3 e XeCl2?
Responda:
Não, porque duas das moléculas não têm ângulos de ligação a 120 °.
Explicação:
Para responder a essa pergunta, você deve desenhar as estruturas de Lewis dos compostos e determinar suas formas de VSEPR.
"SeS"_3
A estrutura de Lewis "SeS"_3 is

(A partir de www.homeworklib.com)
Esta é uma "AX"_3 molécula e sua geometria é planar trigonal.
Todos os ângulos de ligação em uma molécula planar trigonal são aproximadamente 120 °.
"SeS"_2
A estrutura de Lewis "SeS"_2 is
:stackrel(". .")("S")=stackrel(". .")("Se")=stackrel(". .")("S"):
Esta é uma "AX"_2"E" molécula.
Sua geometria eletrônica é planar trigonal.
O ângulo de ligação em um "AX"_2"E" molécula é de aproximadamente 120 °.
"PCl"_5
A estrutura de Lewis "PCl"_5 is
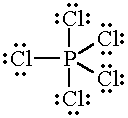
Esta é uma "AX"_5 molécula e sua geometria é piramidal trigonal.
Os ângulos de ligação equatorial em uma molécula bipiramidal trigonal são todos 120 °.
"TeCl"_4
A estrutura de Lewis "TeCl"_4 is

Esta é uma "AX"_4"E" molécula.
Sua geometria eletrônica é piramidal trigonal.
O ângulo de ligação equatorial entre o equatorial "Te-Cl" títulos é de aproximadamente 120 °.
"ICl"_3
A estrutura de Lewis "ICl"_3 is
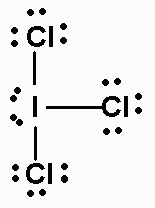
Esta é uma "AX"_3"E"_2 molécula.
Sua geometria eletrônica é piramidal trigonal e sua geometria molecular é em forma de T.
O "I-Cl" ângulos de ligação em uma molécula em forma de T são ambos aproximadamente 90 °.
"XeCl"_2
A estrutura de Lewis "XeCl"_2 is
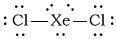
Esta é uma "AX"_2"E"_3 molécula.
Sua geometria eletrônica é piramidal trigonal, com os pares solitários nas posições equatoriais.
A molécula é linear, com um "Cl-Xe-Cl" ângulo de ligação de 180 °.

