Como uma ligação covalente polar difere de uma não polar?
As ligações covalentes polares são um tipo particular de ligação covalente.
Em uma ligação covalente polar (por exemplo, água), os elétrons compartilhados pelos átomos gastam uma quantidade de tempo maior, em média, mais perto do núcleo de oxigênio que o núcleo de hidrogênio. Isso é por causa do geometria da molécula e a ótimo eletro-negatividade diferença entre o átomo de hidrogênio e o átomo de oxigênio.

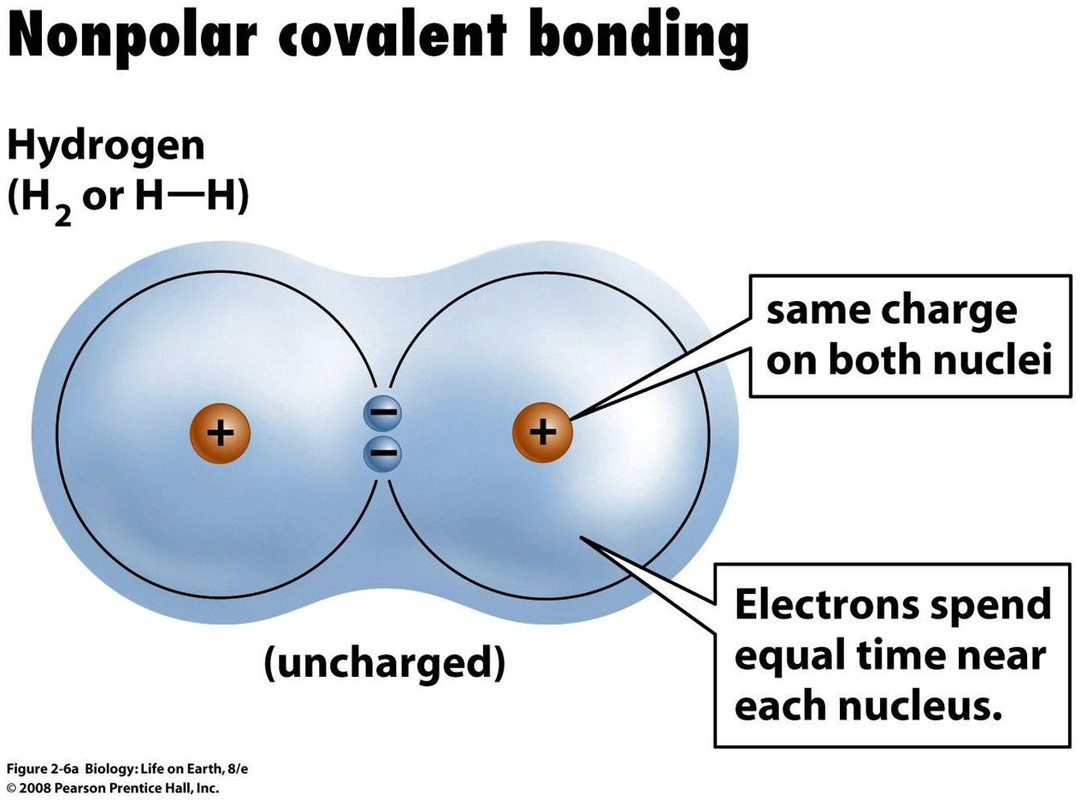
As ligações covalentes não polares são um tipo de ligação que ocorre quando dois átomos compartilham um par de elétrons um com o outro. Esses elétrons compartilhados colam dois ou mais átomos para formar uma molécula.
Um exemplo de ligação covalente não polar é a ligação entre dois átomos de hidrogênio porque eles compartilham igualmente os elétrons .
Você pode ler mais sobre isso Aqui.

