Como a pressão atmosférica e a elevação afetam o ponto de ebulição?
Responda:
- À medida que a elevação aumenta, pressão atmosférica e diminuição do ponto de ebulição.
Explicação:
-
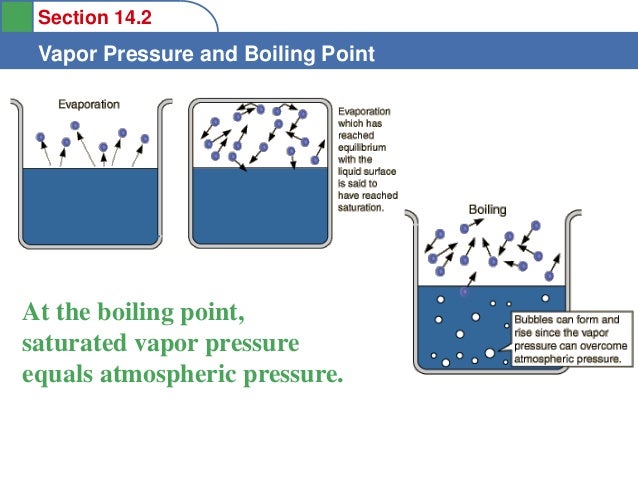
Ponto de ebulição é o ponto em que a pressão do vapor é igual à pressão atmosférica.
-
Em um líquido, algumas partículas sempre têm energia suficiente para escapar para a fase gasosa. As partículas gasosas também estão retornando ao líquido.
-
O pressão de vapor é a pressão exercida pelo gás quando a quantidade de partículas que sai do líquido é igual à quantidade de partículas que entram no líquido

(de facweb.bhc.edu)
- À medida que a temperatura aumenta, mais partículas têm energia suficiente para escapar para a fase gasosa. Isso aumenta a pressão do vapor. Quando a pressão do vapor é igual à pressão atmosférica, o líquido ferve.
À medida que a elevação aumenta, a pressão atmosférica diminui porque o ar é menos denso em altitudes mais altas.

Como a pressão atmosférica é menor, a pressão de vapor do líquido precisa ser menor para atingir o ponto de ebulição.
Portanto, é necessário menos calor para tornar a pressão do vapor igual à pressão atmosférica. O ponto de ebulição é mais baixo em grandes altitudes.
Aqui está um vídeo que demonstra o efeito da pressão atmosférica no ponto de ebulição.

