Como a hibridação se relaciona com a geometria molecular?
Químicos usam hibridação para explicar geometria molecular.
VSEPR A teoria prevê a geometria, e os químicos usam a hibridação para explicá-la.
Eles costumavam dizer:
linear → sp
planar trigonal → sp²
tetraédrico → sp³
piramidal trigonal → sp³d
octaédrica → sp³d²
Mas a hibridação funciona apenas para elementos no segundo período de a tabela periódicae melhor para o carbono.
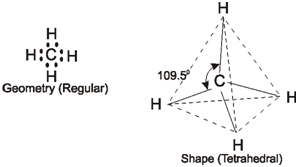
Em CH₄, o ângulo de ligação é 109.5 °. Este é o ângulo de ligação do sp³.
Em H₂O, o ângulo de ligação é 104.45 °.
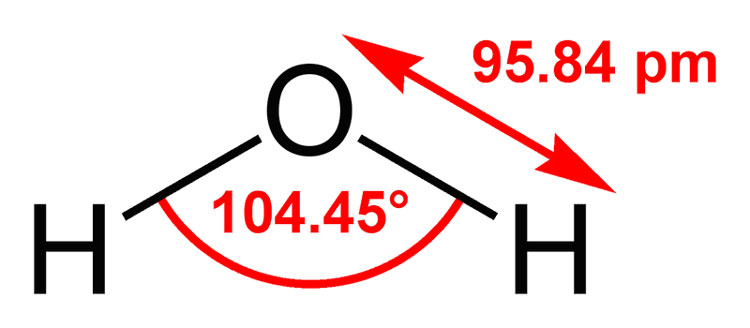
Isso é "próximo" ao ângulo de ligação sp³ de 109.5 °.
Para elementos nos períodos 3 e acima, os ângulos de ligação são ainda maiores daqueles previstos pelos orbitais híbridos,

Em H₂S, o ângulo de ligação é 92.1 °. Isso está muito mais próximo do 90 ° do que do 109.5 °. Isso sugere que S usa orbitais p não hibridados para formar as ligações SH.
Os químicos agora acreditam que os orbitais d não estão envolvidos nas geometrias trigonométricas bipiramidais e octaédricas. Portanto, não há hibridação sp³d ou sp³d².
Eles acreditam que o PF₅ não expande seu octeto. Em vez disso, a molécula é uma ressonância híbrido de cinco estruturas de Lewis.

Duas estruturas têm ligações iônicas nas posições axiais e três possuem ligações iônicas nas posições axiais.
SF₆ é um híbrido de ressonância de estruturas que possui quatro ligações covalentes e duas ligações iônicas.

Existem estruturas 12 com as duas ligações iônicas adjacentes (cis), como mostrado, mais estruturas 3 com as duas ligações iônicas opostas (trans) posições. Isso totaliza os contribuidores do 15.

