Como as estruturas de ressonância afetam a acidez?
Responda:
Resposta curta: Ressonância estruturas que estabilizam uma base conjugada aumentam a acidez.
Explicação:
Considere as acidez do metanol e do ácido acético.
CH2OH + H2O2CH2O2 + H2O2; pK_"a" = 15
CH2COOH + H2O2CH2COO2 + H2O2; pK_"a" = 5
Por que o ácido acético 10^10 vezes mais ácido que o metanol?
Responda: Aqui está a minha explicação.
No íon metóxido, a carga negativa é localizada (concentrada) no átomo de oxigênio.
A ressonância estabiliza o ácido acético e o íon acetato,
No ácido acético, a estabilização é pequena porque a contribuição da ressonância envolve a separação da carga.
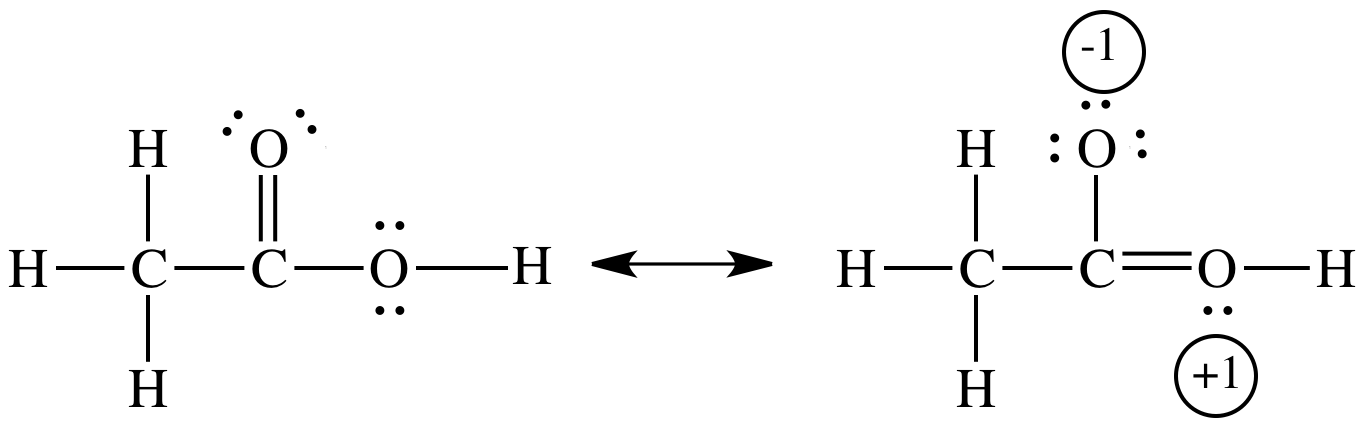
No íon acetato, não há separação de carga.
Em vez disso, a carga negativa é deslocalizada (espalhada) por três átomos. Essa deslocalização produz um estado de menor energia.
Se os produtos de uma reação forem mais estáveis que os reagentes, a posição de equilíbrio estará à direita.
Assim, a estabilização por ressonância do íon acetato torna o ácido acético mais ácido que o metanol.
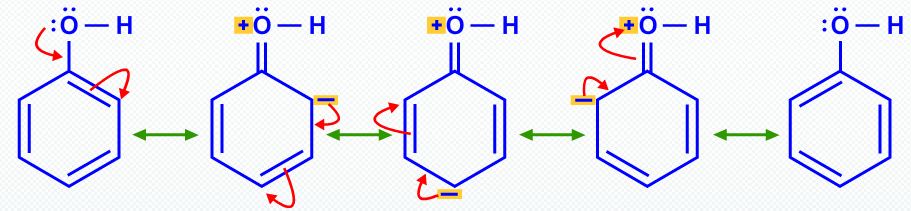
Do mesmo modo, a ressonância torna o fenol mais ácido que o etanol.
Não há estabilização de ressonância no íon etóxido.
"CH"_3"CH"_2"OH" + "H"_2"O" ⇌ "CH"_3"CH"_2"O"^"-" + "H"_3"O"^"+"; "p"K_text(a) = 17
A ressonância estabiliza o íon fenol e fenóxido por deslocalização de elétrons no anel.
No entanto, essa localização no fenol envolve a separação da carga e torna o átomo de oxigênio positivo.
A mesma deslocalização no íon fenóxido fornece muito mais estabilização porque não há separação de carga.

A posição do equilíbrio está à direita. "p"K_text(a) = 10.
Assim, o fenol é 10^7 vezes mais ácido que o etanol, porque a ressonância estabiliza o íon fenóxido.