Como as ligações pi e sigma se relacionam com a hibridação?
Responda:
A maioria dos átomos hibrida seus orbitais atômicos s e p para obter os orbitais moleculares mais estáveis.
Explicação:
A concha de valência de um átomo possui um orbital s e três orbitais p.
Quando dois orbitais s se sobrepõem, eles formam uma ligação σ.
Quando dois orbitais p se sobrepõem lado a lado, eles formam uma ligação π.

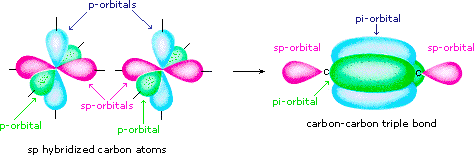
orbitais s e p podem formar diferentes hibridizações.
s + p → sp
s + p + p → sp²
s + p + p + p → sp³
Quando dois orbitais hibridizados se sobrepõem, eles formam uma ligação σ.
Os átomos hibridados com sp³ usam todos os três orbitais p para a hibridação. Isso significa que os átomos sp³ hibridizados podem formar apenas ligações sigma. Eles não podem formar múltiplos vínculos.
Os átomos hibridizados com sp² usam apenas dois orbitais p na hibridação. Existe um orbital p não utilizado. Esse orbital p restante pode criar uma ligação π com outro átomo e criar uma ligação dupla.

átomos sp-hibridizados usam apenas um orbital p na hibridação. Isso significa que você pode criar duas ligações π.