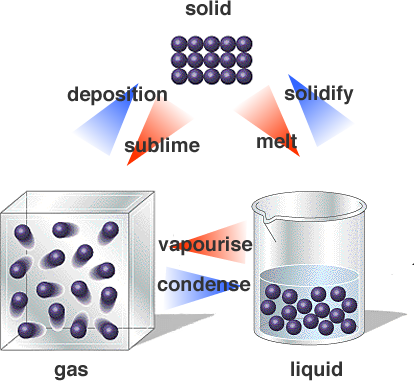
Como as mudanças de estado podem ser explicadas pela teoria das partículas?
À medida que as partículas ganham energia suficiente, elas podem escapar das atrações de seus vizinhos e entrar em um estado mais fluido.
Todas as partículas se atraem. Ao mesmo tempo, todas as moléculas estão em movimento constante. Suas energias cinéticas os separam.
A baixas temperaturas, a energia cinética das moléculas é baixa. As partículas não podem se mover rápido o suficiente para se afastar das atrações de seus vizinhos. Eles são "colados" no lugar para que possam vibrar apenas um pouco de um lado para o outro em um arranjo cristalino. As moléculas estão no sólido Estado.
Em temperaturas mais altas, a energia cinética das partículas é maior. As partículas têm energia suficiente para passar por seus vizinhos. Eles não têm energia suficiente para escapar das atrações de seus vizinhos. O sistema está no líquido Estado.
Em altas temperaturas, a energia cinética das partículas é alta. As partículas podem escapar das atrações de seus vizinhos e se mover à vontade dentro do recipiente. O sistema está no gás Estado.