Como classifico os seguintes compostos do ponto mais baixo ao ponto de ebulição mais alto: carbonato de cálcio, metano, metanol (CH₄O), éter dimetílico (CH₃OCH₃)?
Responda:
A ordem dos pontos de ebulição é: #"CH"_4 < "CH"_3"OCH"_3 < "CH"_4"O" < "CaCO"_3#
Explicação:
A ordem das forças das forças intermoleculares é: #"ion-ion > H-bonding > dipole-dipole > London dispersion"#.
Compostos com forças intermoleculares mais fortes têm pontos de ebulição mais altos.
A força intermolecular mais forte em cada um dos compostos é:
#"CaCO"_3# - atrações de íons de íons.
#"CH"_4# - forças de dispersão de Londres
#"CH"_3"OH"# - ligação de hidrogênio
#"CH"_3"OCH"_3# - atrações dipolo-dipolo
#"CaCO"_3# é um composto iônico. Possui os mais altos pontos de ebulição
A seguir vem o metanol, #"CH"_4"O"# or #"CH"_3"OH"#.
O metanol tem forte ligações de hidrogênio. Ele terá o próximo ponto de ebulição mais alto.
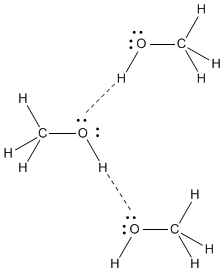
Éter dimetil, #"CH"_3"OCH"_3#, é uma molécula polar.
O #"C-O"# dipolos de ligação se reforçam, de modo que a molécula tem um momento dipolar.
As forças dipolo-dipolo não são tão fortes quanto as ligações de hidrogênio, portanto o éter dimetílico tem um ponto de ebulição mais baixo do que o metanol.
Finalmente, o #"C-H"# ligações no metano são não-polares, então a molécula também é não-polar.
Possui apenas forças fracas de dispersão em Londres,

#"CH"_4#, tem o ponto de ebulição mais baixo.
A ordem dos pontos de ebulição é:
#"CH"_4 < "CH"_3"OCH"_3 < "CH"_4"O" < "CaCO"_3#
Aqui está um bom vídeo sobre como encomendar compostos de acordo com suas forças intermoleculares e pontos de ebulição.

