Como posso classificar cada espécie como um ácido de Lewis ou uma base de Lewis para # BeCl_2 #, #OH ^ - #, #B (OH) _3 # e #CN ^ - #?
Você desenha as estruturas de Lewis e toma uma decisão com base em possíveis reações.
Uma substância pode ser um ácido de Lewis ou uma base de Lewis, dependendo da reação. Mas muitas vezes você pode fazer uma boa previsão.
BeCl₂
A estrutura de Lewis para BeCl₂ é

Vemos que o átomo Be tem apenas quatro elétrons em sua camada de valência. Be tem um octeto incompleto.
O átomo Be aceitará elétrons para completar seu octeto.

Então BeCl₂ é um ácido de Lewis.
OH⁻
A estrutura de Lewis de OH⁻ é

O átomo O possui três pares solitários de elétrons. Ele pode doar esses elétrons para formar uma ligação com outro átomo.

OH⁻ é uma base de Lewis.
B (OH) ₃
A estrutura de Lewis de B (OH) ₃ é

O átomo B tem um octeto incompleto, portanto, ele pode atuar como um ácido de Lewis.
HO⁻ + B (OH) ₃ → [HO-B (OH) ₃] ⁻
B (OH) ₃ também é um oxiácido. Portanto, o átomo H também pode atuar como um ácido de Lewis.
HO⁻ + HOB (OH) ₂ → H₂O + ⁻OB (OH) ₂
Seja como for, B (OH) ₃ é um ácido de Lewis.
CN⁻
A estrutura de Lewis da CN⁻ é
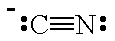
O átomo C tem um par solitário e uma carga negativa; portanto, ele se comportará como uma base de Lewis.
N≡C: ⁻ + CH₃-Br → N≡C-CH₃ + Br⁻
Aqui está um vídeo sobre como identificar ácidos e bases de Lewis.

