Qual das seguintes opções deve exibir ressonância? (A) CO_2 CO2 (B) NH_4 ^ (+) NH+4 (C) HCN HCN (D) NO_2 "" ^ (-) NO2−
Responda:
A resposta esperada é provavelmente D) "NO"_2^-NO−2.
Explicação:
Ambos "CO"_2CO2 e "HCN"HCN também exibem ressonância, mas eles têm apenas um dos principais colaboradores. "CO"_2CO2 tem dois principais colaboradores.
Para determinar se a ressonância é possível, desenhe a estrutura de Lewis e veja se é possível colocar os elétrons em locais diferentes.
A) "CO"_2CO2
A estrutura de Lewis para "CO"_2CO2 is

Existem outros dois contribuidores de ressonância, mas eles envolvem separação de carga e, portanto, são contribuintes menores.
B) "NH"_4^+NH+4
A estrutura de Lewis "NH"_4^+NH+4is
Essa é a única estrutura de Lewis - sem ressonância.
C) "HCN"HCN
A estrutura de Lewis "HCN"HCN is

Você pode desenhar uma estrutura com um "C=N"C=N obrigações, mas cobra taxas formais "C"C e "N"N, por isso é um colaborador menor.
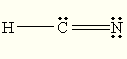
D) "NO"_2^-NO−2
"NO"_2^-NO−2 tem duas estruturas de Lewis equivalentes. Ambos são os principais contribuintes de ressonância.

