Qual é o momento dipolar do tricloreto de nitrogênio?
O momento dipolar de NCl₃ é 0.6 D.
A estrutura de Lewis de NCl₃ é
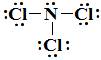
NCl2 possui três pares solitários e um par de ligação. Isso a torna uma molécula de AX₃E.
Os quatro domínios eletrônicos fornecem uma geometria eletrônica tetraédrica. O par solitário torna a forma molecular trigonal piramidal.
N e Cl têm quase exatamente as mesmas eletronegatividades. A diferença de eletronegatividade é tão pequena que as ligações N-Cl são não polares.
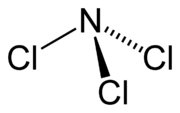
Então, qual é a fonte do momento dipolar? Resposta: o par solitário.
Um par solitário contribuirá para um momento dipolar. Cálculos teóricos mostram que a contribuição de um par sp³ solitário de nitrogênio pode ser tanto quanto 1.3 D.
Portanto, é razoável que o momento dipolar de NCl₃ seja 0.9 D.

