Qual dos seguintes compostos pode ter a maior energia da rede?
Responda:
(1) O MgO possui a maior energia da rede.
Explicação:
A energia da rede depende da atração entre os íons de carga oposta.
A força da atração F é diretamente proporcional às cobranças (q_1 e q_2) nos dois íons e na distância r entre eles.
F = (q_1q_2)/r^2
A distância entre as cargas r é a soma dos raios iônicos.
r = r_"anion" + r_"cation"
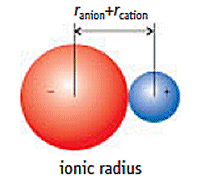
Portanto, as maiores atrações serão entre os íons que possuem os menores raios.

E, como a atração depende do produto das cobranças, procuramos íons com a maior carga.
Tanto no CaO quanto no MgO, as cargas são +2 e -2; portanto, a escolha é entre esses dois óxidos.
Os íons menores serão capazes de se aproximar um do outro.
Eles terão a menor distância entre os centros e as maiores energias de treliça.
Os menores íons estão no topo da Tabela periódica.
"Mg"^(2+) É menor que "Ca"^(2+), assim "MgO" tem a maior energia da rede.

