Qual é a ordem de prioridade de fatores como ressonância, hibridação, solvatação etc. na determinação da acidez relativa ou basicidade dos compostos em uma lista?
Responda:
ATENÇÃO! Resposta longa! Aqui estão os meus pensamentos.
Explicação:
Qualquer coisa que diminua a "X-H"X-H a força de ligação no ácido ou estabiliza a base conjugada aumentará a acidez e diminuirá a basicidade da base conjugada.
Eu identificaria os fatores na ordem 1. bb"R"Risonância; 2. bb"A"Atom; 3. bb"D"Dipole bb"I""Iefeito indutivo; 4. bb"O"Orbitais (bb"RADIO"RADIO).
Ácidos fortes
Existem seis ácidos fortes comuns. Em ordem crescente de acidez, são eles:
"HNO"_3 < "H"_2"SO"_4 < "HCl" < "HBr" < "HI" < "HClO"_4HNO3<H2SO4<HCl<HBr<HI<HClO4
Qualquer ácido forte é mais forte que a maioria dos ácidos orgânicos.
Alguns fatores a serem considerados são:
1. Ressonância
Coloquei a estabilização por ressonância do ânion primeiro na lista.
Quanto mais contribuidores de ressonância tiver uma base conjugada, mais forte será o ácido.
Isso explica em parte por que o ácido sulfúrico é mais forte que o ácido nítrico.
Também explica por que o ácido acético ("p"K_"a" ≈5pKa≈5) é um ácido mais forte que
etanol ("p"K_"a" ≈ 16pKa≈16).
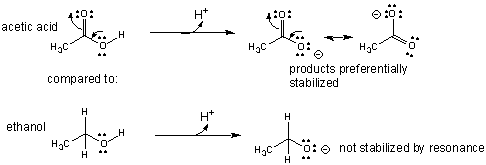
2. átomo
(A) A acidez do HX aumenta da esquerda para a direita a tabela periódica.
color(white)(mmml)"CH"_4 < color(green)("N")"H"_3 < color(red)("H")_2"O" < "H"color(lime)("F")mmmlCH4<NH3<H2O<HF
"p"K_"a"color(white)(m)~50color(white)(mmll)38color(white)(mml)15.7color(white)(mm)3.2pKam~50mmll38mml15.7mm3.2
à medida que o eletro-negatividade of "X"X aumenta, o ligação elétrons são puled mais perto de "X"X e a acidez aumenta.
A exceção é "HF"HF, para o qual a base conjugada "F"^"-"F- é estabilizado por solvatação por moléculas de água.
(B) A acidez aumenta de cima para baixo na tabela periódica.
color(white)(mmml)"HF" < "HCl" < "HBr" < "HI"mmmlHF<HCl<HBr<HI
"p"K_"a"color(white)(ml)3.8color(white)(mll)"-8.0"color(white)(mm)"-9.0"color(white)(mll)"-10"pKaml3.8mll-8.0mm-9.0mll-10
À medida que você desce em um grupo, o comprimento da ligação se torna mais longo e mais fraco, e a carga densidade no íon diminui.
3. bb"D"Dipoles e bb"I"IEfeitos indutivos
Átomos eletronegativos atraem carga negativa para si mesmos.
Isso enfraquece a ligação HX e estabiliza a base conjugada.
O efeito diminui com a distância do ácido "H"H átomo.

(Do SlidePlayer)
Grupos alquil são grupos doadores de elétrons.
Eles empurram a densidade de elétrons para o "COOH"COOH agrupar e desestabilizar o íon carboxilato.
Quanto mais grupos alquil, mais fraco é o ácido.
4. Orbitais
O mais "s"s caractere em um orbital, mais próximos os elétrons estarão do núcleo.
À medida que avançamos "sp"^3sp3 (alcano) a "sp"^2sp2 (alceno) a "sp"sp hibridização (alcina), a estabilidade da carga negativa aumenta.
Os alcinos são notavelmente ácidos em comparação com os alcanos.

Aqui está um resumo da discussão.

